Maya Amitaia,b,c,∗, Michal Taler b,d, Maya Lebow c, Reut Ben-Baruch a, Alan Apter a,b, Silvana Fennig a,b,Abraham Weizmanb,d,f, Alon Chenc,e,g
Pubblicato su European Neuropsychopharmacology 2020
Traduzione in italiano a cura del Dott. Claudio Ajmone per GiùleManidaiBambini.org
Testo originale in inglese, disponibile a questo link
a Department of Psychological Medicine, Schneider Children’s Medical Center of Israel, Petach Tikva, Israel
b Sackler Faculty of Medicine, Tel Aviv University, Tel Aviv, Israel
c The Ruhman Family Laboratory for Research on the Neurobiology of Stress, Department of Neurobiology, Weizmann Institute of Science, Rehovot, Israel
d Laboratory of Biological Psychiatry, Felsenstein Medical Research Center, Petach Tikva, Israel
e Schneider Children’s Medical Center of Israel, Petach Tikva, Israel
f Research Unit, Geha Mental Health Center, Petach Tikva, Israel
g Department of Stress Neurobiology and Neurogenetics, Max-Planck Institute of Psychiatry, Munich, Germany
Il disturbo depressivo maggiore (MDD) è associato ad alterazioni delle citochine circolatorie, negli adulti così come nei bambini e negli adolescenti. La somministrazione di inibitori selettivi della ricaptazione della serotonina (SSRI) a pazienti pediatrici con MDD modifica i livelli di citochine. Tuttavia, la maggior parte degli studi ha valutato i cambiamenti solo in un breve periodo di tempo. In questo studio, abbiamo valutato gli effetti a lungo termine della fluoxetina SSRI (FLX) in bambini e adolescenti trattati per ansia e/o MDD, incluso un gruppo ad alto rischio con suicidalità pre-trattamento. Il gruppo di studio comprendeva novantadue pazienti (35 ragazzi e 57 ragazze) con MDD e/o disturbi d’ansia, di età compresa tra 13,90 ± 2,41 anni.
Tutti i pazienti sono stati trattati con FLX e seguiti per 6 mesi. Il gruppo di studio includeva bambini con suicidalità pretrattamento (gruppo ad alto rischio; N = 62) e senza pretrattamento suicidalità ( N = 30) secondo la Columbia Suicide Severity Rating Scale. Le concentrazioni plasmatiche di TNFα, IL-6 e IL-1β sono state misurate mediante saggi di immuno assorbimento enzimatico prima e dopo sei mesi di trattamento. IL-6 e IL-1β sono aumentati significativamente come fattore di tempo dopo 6 mesi di trattamento.
L’elevazione era statisticamente significativa limitata ai bambini con suicidalità pretrattamento. All’interno dei bambini con suicidalità pretrattamento, i livelli di IL-6 sono aumentati significativamente dopo 6 mesi solo nei bambini che hanno sviluppato suicidalità associata a SSRI. Per riassumere, un aumento dei livelli di IL-6 dopo 6 mesi di trattamento può essere associato a suicidalità emergente da SSRI nei bambini con suicidalità pretrattamento. Sono necessari ulteriori studi per chiarire il ruolo e i meccanismi dell’IL-6 nella patogenesi di questo evento avverso potenzialmente letale.
1. Introduzione
La disregolazione immunitaria è stata implicata nella fisiopatologia del disturbo depressivo maggiore (MDD) ( Dantzer et al., 2008 ; Schmidt et al., 2016 ). Le citochine proinfiammatorie possono contribuire ai disturbi comportamentali e immunitari osservati in questi pazienti, negli adulti così come nei bambini e negli adolescenti ( Dowlati et al., 2010 ; Mills et al., 2013 ; Mitchell e Goldstein, 2014 ). Inoltre, diversi studi hanno dimostrato che le anomalie nei livelli di citochine comprendono fattori di rischio per comportamenti suicidi (SB) oltre alla loro associazione con sintomi depressivi ( Keaton et al., 2019). I fattori infiammatori possono raggiungere il sistema nervoso centrale attraverso diversi meccanismi e all’interno del cervello possono svolgere un ruolo nell’innescare i sintomi affettivi.
Gli inibitori selettivi della ricaptazione della serotonina (SSRI) sono comunemente usati per trattare la depressione e/o l’ansia nella popolazione pediatrica. Diversi studi hanno dimostrato che la neuroinfiammazione può essere influenzata da interventi farmacologici e in particolare dagli SSRI (per una revisione completa, vedere Wang et al. (2019) ). La maggior parte degli studi ha indicato che il trattamento con SSRI può causare una riduzione dei marker infiammatori periferici ( Hannestad et al., 2011 ; Hiles et al., 2012 ).
Tuttavia, la maggior parte delle indagini ha esaminato solo l’influenza a breve termine degli SSRI e solo una scarsità di studi ha valutato l’effetto a lungo termine degli SSRI sui marcatori infiammatori e la rilevanza per il comportamento. Uno studio ha mostrato un incremento di IL-2 e IL-1β dopo 52 settimane di trattamento con SSRI (Hernández et al., 2008 ). Ad oggi, nessuno studio ha valutato gli effetti a lungo termine degli SSRI nella popolazione pediatrica. Inoltre, nessuno studio ha valutato i marcatori infiammatori negli eventi avversi (AE) indotti da SSRI e in particolare nell’aggravamento degli SB associato a SSRI, un noto AE degli SSRI nella popolazione pediatrica ( Hammad et al., 2006).
Questo fenomeno è particolarmente preoccupante nei bambini ad alto rischio con suicidalità pretrattamento ( Wilkinson et al., 2011 ). In uno studio precedente, il nostro gruppo ha dimostrato che un aumento dei livelli di IL-6 durante 8 settimane di trattamento con fluoxetina (FLX) è un fattore di rischio per l’emergere della suicidalità associata agli SSRI ( Amitai et al., 2019 ).
Nel presente studio, abbiamo valutato le citochine pro-infiammatorie dopo 6 mesi di follow-up. Abbiamo ipotizzato che un processo neuroinfiammatorio persistente, come indicato da livelli in continuo aumento di citochine pro-infiammatorie, possa essere rilevato nei bambini affetti da MDD e/o ansia, nonostante un adeguato trattamento con SSRI. Inoltre, abbiamo ipotizzato che tale processo neuroinfiammatorio possa essere più pronunciato in un gruppo ad alto rischio di bambini e adolescenti con SB pretrattamento trattati con FLX, e in particolare nei bambini che sviluppano suicidalità associata a SSRI.
2. Procedure sperimentali
2.1 . Disegno dello studio
Per il disegno dello studio, vedere Amitai et al. (2019). In breve, i bambini con depressione e/o disturbi d’ansia secondo i criteri del Diagnostic and Statistical Manual of Mental Disorders, 5° edizione (DSM-5) ( American Psychiatric Association, 2013 ) sono stati trattati con FLX 20-40 mg . Lo studio è stato approvato dallo Schneider Children’s Medical Center of Israel Review Board (Petach Tikva, Israel) e il consenso informato e l’assenso sono stati ottenuti dai soggetti e dai loro genitori. Dopo una valutazione diagnostica di conferma, tutti i soggetti hanno ricevuto fluoxetina.
Il dosaggio iniziale per tutti i pazienti era di 10 mg/die per una settimana, quindi aumentato a 20 mg/die fino alla settimana 4. La risposta è stata misurata con la scala Clinical Global Impressions–Improvement (CGI-I) ( Guy, 1976). Se il grado di miglioramento era minimo (CGI- I ≥ 3), il dosaggio veniva aumentato da 20 a 40 mg/die alla settimana 5. Una visita di follow-up veniva effettuata ogni due settimane, valutando il miglioramento dei sintomi e degli eventi avversi.
Alla fine dell’ottava settimana, un bambino è stato considerato un rispondente o un non rispondente secondo CGI-I (CGI- I = ½ vs. CGI- I ≥ 3). Lo studio è stato esteso come trattamento clinico aperto per altri 4 mesi, con una visita di follow-up ogni mese. Alla fine del follow-up di 6 mesi, la risposta a lungo termine è stata misurata con il punteggio CGI-I.
Per la valutazione degli AE, vedere Amitai et al. (2019) . Per questo studio, la suicidalità è stata valutata utilizzando la Columbia Suicide Severity Rating Scale (C-SSRS).
Questa scala è progettata per standardizzare la valutazione di un’ampia gamma di comportamenti rilevanti per il suicidio, inclusa la gravità e l’intensità dell’ideazione suicidaria (SI), il tentativo di suicidio (SA) e la letalità dell’AS. Gli eventi suicidi durante il periodo di follow-up sono stati classificati in tre categorie: (1) SA reale – tutti i comportamenti autolesionistici o atti dannosi con l’intenzione di morire; (2) comportamenti di autolesionismo senza intenzione di morire; e (3) nuovo SI o peggioramento di SI (Posner et al., 2011).
La categoria 2 coincide con la recente proposta di includere l’autolesionismo non suicidario (NSSI) come entità nosologica nei criteri di ricerca del DSM (DSM-5). La suicidalità pretrattamento è stata determinata in base alla sottoscala di ideazione. La sottoscala di ideazione è un buon predittore per futuri SA e ha un’elevata sensibilità e specificità per gli SB ( Posner et al., 2011 ). La suicidalità associata agli SSRI è stata valutata in base all’evidenza di una suicidalità clinicamente significativa che si è sviluppata durante l’intero periodo di follow-up (cioè, suicidalità che ha richiesto un intervento medico urgente).
2.2 . Valutazione delle citochine plasmatiche
I campioni di sangue sono stati raccolti da tutti i soggetti prima dell’inizio del trattamento e dopo 6 mesi di follow-up. Da ciascun partecipante, campioni di sangue (20 mL) sono stati raccolti mediante venipuntura tra le 9:00 e le 11:00. I campioni di sangue sono stati immediatamente centrifugati (200 g) a 4 ° C per 10 minuti per ottenere il plasma. I campioni di plasma sono stati separati in aliquote e conservati a -80°C fino al momento del dosaggio. Il plasma è stato utilizzato per la determinazione dei livelli delle citochine pro-infiammatorie umane TNF-α, IL-6 e IL-1β.
Le citochine sono state misurate nel plasma secondo le istruzioni del produttore (R&D Systems, Minneapolis, MN). Le misurazioni delle citochine per tutti i partecipanti sono state condotte in duplicato nella stessa corsa per evitare la variabilità tra i saggi. Le citochine sono state dosate su sette piastre da 96 pozzetti con campioni di tutti i gruppi distribuiti uniformemente.
Tutte le citochine sono state valutate con un test di immunoassorbimento enzimatico sandwich (ELISA) basato su una coppia di anticorpi monoclonali-monoclonali e un sistema di amplificazione biotina-streptavidina (Siemens Medical Solutions Diagnostics, Los Angeles, CA), seguendo il protocollo del produttore. Il team di laboratorio era all’oscuro dei dati clinici e il team clinico era all’oscuro dei dati di laboratorio. Sono stati inclusi nell’analisi solo i bambini con misurazioni di citochine disponibili.
2.3 . Statistiche
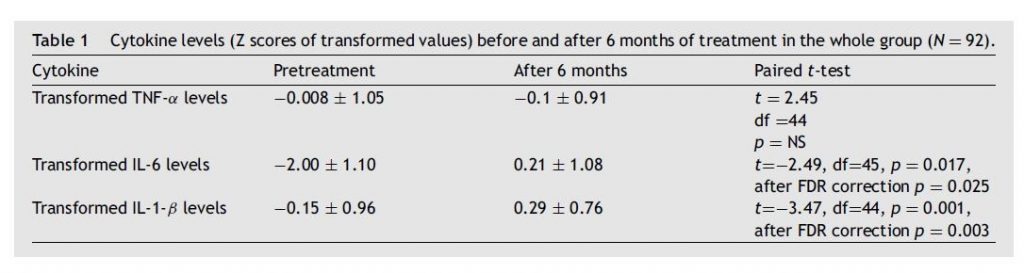
Il pacchetto statistico per le scienze sociali (SPSS) è stato utilizzato per creare un database e per condurre le analisi statistiche (versione 17 per Windows, SPPS Inc., Chicago, IL). I dati per tutte e tre le citochine sono stati trasformati nella distribuzione normale utilizzando i logaritmi naturali per le analisi statistiche. Per evitare variazioni da lotto a lotto, tutti i livelli di citochine sono stati normalizzati utilizzando punteggi z . Ai campioni con livelli di citochine inferiori al limite di rilevamento è stato assegnato un valore corrispondente al valore rilevabile più basso nel dosaggio. I t- test appaiati e non appaiati sono stati utilizzati a seconda dei casi.
3. Risultati
3.1 . Tutto il gruppo
3.1.1 . Soggetti
Sono stati sottoposti a screening oltre 300 bambini e adolescenti, di cui 96 idonei a partecipare allo studio e che hanno dato il loro assenso. Un bambino ha ritirato il suo consenso prima dell’inizio della terapia. Complessivamente, 95 bambini costituivano la popolazione intent-to-treat. Tre bambini hanno abbandonato prima di terminare il follow-up di 8 settimane (uno a causa di attacchi di panico e gli altri due per ragioni sconosciute), quindi 92 soggetti hanno completato le 8 settimane di follow-up.
Settantotto pazienti hanno completato un follow-up di 6 mesi. Alla fine dello studio, 50 bambini (54% del campione dello studio) erano ancora in FLX all’ultima visita di follow-up. Tutti gli altri erano stati passati a un SSRI diverso (sertralina o escitalopram). I dettagli demografici dei 92 soggetti sono stati precedentemente descritti ( Amitai et al., 2019).
Il campione dello studio era composto come segue: 35 (38%) ragazzi e 57 (62%) ragazze di 13,90 ± 2,41 anni, 7 (8%) avevano una diagnosi di MDD da solo, 67 (72,8%) avevano diagnosi combinate di MDD e disturbi d’ansia e 18 (20%) hanno avuto una diagnosi di soli disturbi d’ansia (disturbo d’ansia generale, disturbo d’ansia sociale, disturbo di panico con o senza agorafobia, disturbo d’ansia da separazione, fobia specifica o una combinazione di questi disturbi). Il numero medio di disturbi d’ansia era 1,85 ± 1,13 per paziente.
Dei soggetti con MDD, 17 (19%) avevano una diagnosi di doppia depressione come diagnosi principale, 15 (16%) bambini avevano disturbo ossessivo-compulsivo (DOC), 14 (15,2%) avevano disturbi alimentari e 47 (51%) aveva un disturbo da deficit di attenzione/iperattività (ADHD). Il BMI medio del pretrattamento era 20,62 ± 4,07 Kg/m 2. Sei bambini (7%) avevano avuto un precedente studio con un SSRI, 59 (67%) avevano un parente di primo grado con MDD unipolare e 9 (10%) avevano un parente di secondo grado con MDD unipolare.
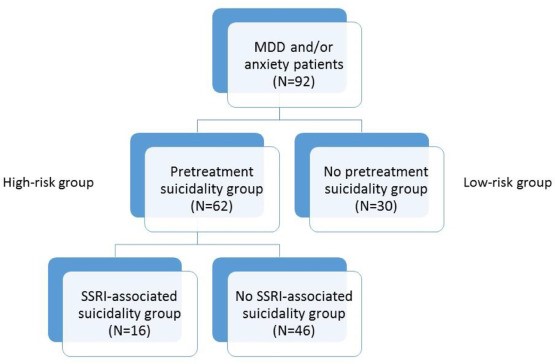
Quattro bambini (4%) avevano un parente di primo grado con disturbo bipolare (BPD) e 10 (11%) avevano un parente di secondo grado con BPD. L’intero gruppo di studio ( N = 92) è stato diviso in due gruppi: quelli con suicidalità pretrattamento (“il gruppo ad alto rischio”, N = 62) e i pazienti senza suicidalità pretrattamento (“il gruppo a basso rischio”, N = 30). Il gruppo ad alto rischio è stato ulteriormente suddiviso in due gruppi: bambini che hanno sviluppato suicidalità associata a SSRI durante il follow-up (“gruppo di suicidalità associata a SSRI”, N = 16) e bambini che non hanno sviluppato suicidalità associata a SSRI (“il gruppo di suicidalità non associato a SSRI”, N = 46). Vedere la Fig. 1 per un riepilogo dei diversi gruppi nello studio. Sessantasei (72%) bambini sono stati valutati come buoni responder nel follow-up a lungo termine.
3.2 . Livelli di citochine in tutto il gruppo I livelli di TNF-α non sono cambiati in modo significativo dopo 6 mesi di trattamento (test t accoppiato , p = NS); sia trasformato IL-6 e IL-1β significativamente aumentati come fattore di tempo dopo 6 mesi di trattamento (a coppie t -test: t . = -2 7 4, df = 66, p = 0,008, dopo FDR correzione p = 0.012, e t =-3,26, df=65, p = 0,002, dopo la correzione FDR p = 0,006, rispettivamente). Vedi Fig. 2 e Tabella supplementare S1 per i livelli grezzi delle citochine misurate. Non è stata osservata alcuna differenza nell’esito immunologico tra i pazienti che hanno continuato con fluoxetina rispetto a quelli che sono passati ad altri SSRI.
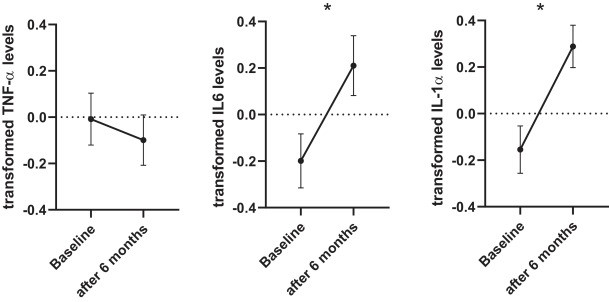
Figura 2 . Z score dei livelli log delle tre citochine misurate al basale e dopo 6 mesi di trattamento con SSRI nell’intero gruppo ( N = 67) * p (IL-6) = 0,012, p (IL-1β) = 0,006.
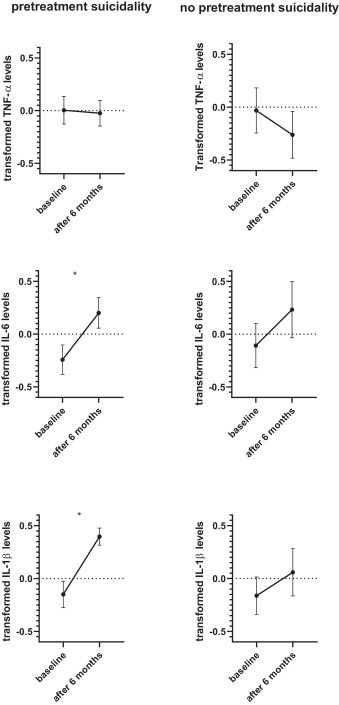
Il gruppo di studio totale ( N = 92) è stato diviso in due gruppi in base alla suicidalità pretrattamento: sessantadue soggetti avevano un grado diverso da zero nella sottoscala di ideazione del C-SSRS (il gruppo ad alto rischio, N = 62). In questo gruppo, i livelli di TNF-α non sono cambiati significativamente dopo 6 mesi di trattamento (test t accoppiato , p = NS); ma entrambi i livelli di IL-6 e IL-1-β trasformati sono aumentati significativamente come fattore di tempo dopo 6 mesi di trattamento (test t accoppiato : t =-2,49, df=45, p = 0,017, dopo correzione FDR p = 0,025 , e t =−3.47, df=44, p = 0.001, dopo correzione FDR p = 0,003, rispettivamente).
Nel gruppo senza suicidalità pretrattamento (il gruppo a basso rischio, N = 30) non sono state riscontrate differenze significative nei livelli di citochine tra il basale e 6 mesi di trattamento ( t- test accoppiato , dati non mostrati). Vedere la Tabella 1 e le Figg. 2 e 3 per i punteggi Z dei livelli trasformati delle citochine misurate.
3.3 . Il “gruppo pretrattamento suicidalità” (gruppo ad alto rischio)
Un’ulteriore analisi è stata eseguita sul “gruppo di suicidalità pretrattamento” (il gruppo ad alto rischio): questo gruppo includeva 23 (37%) ragazzi e 39 (63%) ragazze di età compresa tra 14,27 ± 2,33 anni. Sette bambini (11%) sono stati trattati per depressione, 7 (11%) per disturbi d’ansia e 48 (77%) per una combinazione di depressione e ansia. Sedici bambini (26%) hanno sviluppato SB clinicamente significativi durante l’intero periodo di follow-up. Di questi, 7 avevano avuto un SA, 5 avevano un peggioramento o una nuova insorgenza di NSSI e 4 avevano un peggioramento di SI. All’interno del gruppo ad alto rischio, non sono state osservate differenze per quanto riguarda età, sesso, diagnosi e tutti i parametri clinici testati tra coloro che hanno sviluppato suicidalità durante il trattamento di 6 mesi ( N = 16) e coloro che non hanno sviluppato tali comportamenti ( N = 46). Per i dati demografici dei bambini si veda la Tabella 2 .
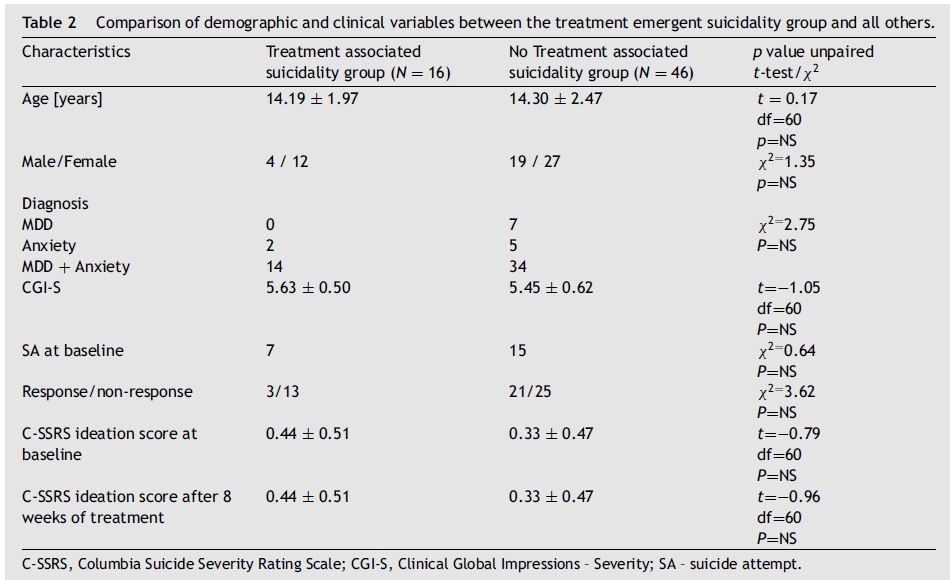
C-SSRS, scala di valutazione della gravità del suicidio della Columbia; CGI-S, Impressioni cliniche globali – Gravità; SA – tentativo di suicidio.
È stata esaminata la relazione tra SA a vita (valutata dal C-SSRS al basale) e suicidalità associata a SSRI durante lo studio. I pazienti con storia di SA, tentativi interrotti e tentativi abortiti ( N = 22) non avevano maggiori probabilità di mostrare suicidalità associata a SSRI durante il trattamento rispetto a quelli senza storia di SA, tentativi interrotti e tentativi abortiti (chi-quadrato: p >0.05 , dati non mostrati).
3.4 . Livelli di citochine nel gruppo ad alto rischio
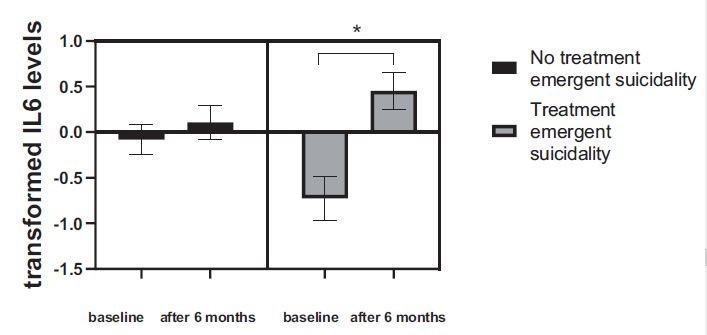
Non sono state riscontrate differenze significative nei livelli di citochine al basale tra i bambini che hanno sviluppato tendenze suicide durante il trattamento con SSRI ( N = 16) rispetto a quelli che non l’hanno fatto ( t- test non appaiato: p >0.05, dati non mostrati). I livelli di IL-6 sono aumentati significativamente solo nei bambini che hanno sviluppato suicidalità associata a SSRI durante il trattamento (“il gruppo di suicidalità associata a SSRI”, N = 16; test t accoppiato : t = -1,19, df=11, p = 0,003, dopo FDR p = 0,006) ( Fig. 4 ). Nessuna alterazione è stata rilevata nei livelli di IL-6 nel gruppo che non ha sviluppato suicidalità associata a SSRI (test t accoppiato , p=NS). Non sono state rilevate differenze nei livelli di TNF-α e IL-1β.
4. Discussione
Una notevole quantità di letteratura si è formata attorno al ruolo dei marker infiammatori nei disturbi mentali, e in particolare nella depressione ( Dowlati et al., 2010 ; Felger e Lotrich, 2013 ). L’interazione tra il sistema nervoso e l’immunità gioca un ruolo importante nella fisiopatologia della MDD. L’infiammazione contribuisce ai sintomi depressivi nei pazienti con MDD ( Lichtblau et al., 2013 ; Maes et al., 2012 ) e alti livelli di citochine proinfiammatorie circolanti sono associati a una risposta più scarsa al trattamento ( Eller et al., 2008 ; Strawbridge et al. , 2015).
Inoltre, gli agenti antinfiammatori possono svolgere un ruolo antidepressivo nei pazienti con MDD ( Bai et al., 2019). Gli SSRI influenzano i livelli di marker infiammatori nei pazienti con MDD, ma gli studi hanno riportato risultati incoerenti. Anche i processi infiammatori sono stati implicati nella suicidalità. Numerosi studi hanno dimostrato che le anomalie nei livelli di citochine comprendono fattori di rischio per gli SB oltre il loro ruolo nel promuovere i sintomi depressivi ( Bastos et al., 2017 ; Black and Miller, 2015 ; Coryell et al., 2018 ; Ducasse et al., 2015 ; Ganança et al., 2016 ; Pandey, 2015 ; Serafini et al., 2013 ).
Ad esempio, i livelli di mRNA e proteine di IL-1β, IL-6, TNF-α e linfotossina A erano significativamente aumentati nella corteccia prefrontale di individui depressi morti per suicidio rispetto ai controlli ( Pandey et al., 2018 ). In uno studio precedente, il nostro gruppo ha esaminato tre citochine proinfiammatorie dopo 8 settimane di trattamento con FLX in bambini e adolescenti trattati per disturbi d’ansia e/o depressivi ( Amitai et al., 2019 ). Abbiamo studiato 3 citochine pro-infiammatorie che sono state più spesso studiate nella ricerca sui disturbi depressivi: IL-1β, IL-6 e TNF-α ( Dowlati et al., 2010 ; Haapakoski et al., 2015 ; Miller et al., 2009 ).
I nostri risultati hanno suggerito che i livelli di IL-6 sono aumentati dopo il trattamento, ma solo nel gruppo di bambini che hanno sviluppato suicidalità associata a FLX, suggerendo che un aumento dei livelli di IL-6 durante il trattamento può essere associato all’emergere di suicidalità associata a FLX ( Amitai et al. al., 2019). Nel presente studio, abbiamo valutato i livelli delle stesse citochine in un follow-up a lungo termine (6 mesi), e in particolare in un gruppo ad alto rischio di bambini e adolescenti con suicidalità pretrattamento.
I fattori di rischio per la suicidalità associata a SSRI nella popolazione pediatrica includono, tra gli altri fattori, un’elevata suicidalità al basale ( Wilkinson et al., 2011 ). Pertanto, è probabile che i bambini con suicidalità pretrattamento costituiscano un gruppo ad alto rischio per questo grave AE. In questo studio, abbiamo valutato gli effetti a lungo termine degli SSRI sulle citochine pro-infiammatorie in bambini e adolescenti trattati per MDD e/o disturbi d’ansia, con particolare enfasi sui bambini con suicidalità pretrattamento (ovvero un gruppo ad alto rischio).
Sono stati osservati tre risultati principali. Innanzitutto, abbiamo scoperto che due delle tre citochine misurate erano elevate nell’intero gruppo dopo 6 mesi, nonostante il trattamento continuo con SSRI. Questo risultato è contrario a quanto descritto in letteratura per quanto riguarda l’effetto degli SSRI sulle citochine periferiche. La maggior parte degli studi mostra che gli SSRI hanno proprietà antinfiammatorie. Una recente meta-analisi di Wang et al. ( Wang et al., 2019) hanno indicato che il trattamento con SSRI negli adulti ha ridotto i livelli dei marker pro-infiammatori IL-6, TNF-α e IL-1β e del marker antinfiammatorio IL-10 nei pazienti con MDD.
Essi ipotizzano che gli effetti immunomodulanti moderati del trattamento con SSRI per la MDD possano essere rilevanti per alcuni degli effetti terapeutici. Tuttavia, la maggior parte degli studi ha valutato i trattamenti a breve termine. Sono stati condotti pochissimi studi sull’influenza a lungo termine degli SSRI sui livelli di citochine. Hernandez et al. ha mostrato negli adulti che dopo 52 settimane di trattamento c’era un aumento di IL-1β e IFN-γ e una diminuzione delle citochine Th2 ( Hernández et al., 2008 ). Hanno concluso che i pazienti depressi raggiungono solo un parziale ripristino del funzionamento neurobiologico dopo la somministrazione a lungo termine di SSRI.
In realtà, nello stesso gruppo di bambini qui riportato, i livelli di citochine non sono cambiati dopo 8 settimane di trattamento ( Amitai et al., 2019 ). Tuttavia, c’è stato un aumento in due delle tre citochine misurate (IL-6 e IL-1β) dopo 6 mesi di trattamento. La somministrazione continua di SSRI induce cambiamenti progressivi nei livelli di serotonina nei pazienti con MDD ( Blardi et al., 2002 ). Pertanto, è importante sottolineare che gli effetti della serotonina sulla risposta immunitaria possono essere dose-dipendenti. Precedenti studi hanno dimostrato che la serotonina induce sia la secrezione di citochine proinfiammatorie che la proliferazione cellulare a concentrazioni fisiologiche (0,15 a 1,5 µg/mL).
Tuttavia, a dosi sovrafisiologiche di serotonina (15 µg/mL), la secrezione di citochine proinfiammatorie è ridotta (Kubera et al., 2005 ). Secondo Kubera et al., la 5-HT intracellulare è necessaria per la sintesi ottimale di IL-6 e TNFα; la serotonina in concentrazioni fisiologiche può aumentare la produzione di IL-6 e TNF-α stimolando i recettori 5-HT2 ( Kubera et al., 2005 ). Pertanto, è possibile che l’assunzione di SSRI nelle prime settimane di trattamento aumenti i livelli circolanti di serotonina plasmatica a livelli sovrafisiologici, che a loro volta sopprimono la produzione di citochine pro-infiammatorie.
Tuttavia, dopo un trattamento a lungo termine, la serotonina ritorna ai normali livelli fisiologici e di conseguenza promuove la secrezione di citochine pro-infiammatorie, come IL-1β, IFN-γ e TNF-α. Pertanto, i nostri risultati qui sono in accordo con i risultati di Hernandez et al. nella popolazione adulta ( Hernández et al., 2008).
Il secondo risultato del nostro studio suggerisce che l’aumento dei livelli di citochine era statisticamente significativo solo nel gruppo di suicidalità pretrattamento (il gruppo ad alto rischio). Entrambi i gruppi hanno mostrato un aumento di IL-6 e IL-1β, ma un significativo aumento persistente era evidente solo nel gruppo ad alto rischio di bambini con suicidalità pretrattamento.
Ciò è indicativo di un processo infiammatorio potenziato in questi bambini nonostante il trattamento con SSRI. La disregolazione del sistema immunitario è già stata associata a sintomatologia suicidaria, sia negli adulti che negli adolescenti ( Courtet et al., 2016 ). Inoltre, le citochine proinfiammatorie sono state implicate nella fisiopatologia degli SB ( Black and Miller, 2015 ; Ducasse et al., 2015 ;Erhardt et al., 2013 ; Ganança et al., 2016 ; Miná et al., 2015 ; Pandey, 2015 ; Serafini et al., 2013 ).
C’è una crescente evidenza che l’infiammazione, come manifestata da un aumento dei livelli di citochine pro-infiammatorie e chemochine infiammatorie, è presente nei pazienti con SB e ideazione. Recentemente, Keaton et al. (2019) hanno mostrato un profilo immunobiologico unico legato all’aumento del rischio di suicidio ( Keaton et al., 2019). Il profilo era diverso da quello osservato nei pazienti con sintomi depressivi. Tuttavia, i risultati sono inconcludenti.
Poche ricerche sono state pubblicate riguardo al sistema infiammatorio nella suicidalità associata agli SSRI, e specialmente nella popolazione pediatrica. I nostri dati precedenti indicano che i livelli di IL-6 differiscono nei bambini che hanno sviluppato la suicidalità associata agli SSRI rispetto ai bambini che non hanno questo AE ( Amitai et al., 2019 ). Pertanto, il presente studio è in accordo con la ricerca che implica l’attivazione immunitaria nella suicidalità.
La nostra terza scoperta suggerisce che all’interno del gruppo di pazienti con suicidalità pretrattamento, vale a dire il gruppo ad alto rischio, solo i bambini che hanno sviluppato suicidalità associata a SSRI hanno avuto un aumento statisticamente significativo dei livelli di IL-6 tra il basale e 6 mesi di somministrazione di SSRI. Entrambi i gruppi hanno mostrato un aumento di IL-6, ma un aumento significativo era evidente solo nei bambini con aggravamento della tendenza al suicidio.
IL-6 è una citochina pro-infiammatoria che è stata precedentemente collegata alla suicidalità in molteplici studi. Infatti, il risultato più consistente in letteratura sui disturbi dell’umore è un’elevata IL-6 nei soggetti con tendenza al suicidio, rispetto ai pazienti senza suicidalità o controlli sani: Isung et al. (2014) hanno mostrato che i tentativi di suicidio violenti tendevano ad essere associati ad alti livelli plasmatici di IL-6 ( Isung et al., 2014 ).
Janelidze et al. (2011) hanno riscontrato un aumento dei livelli di IL-6 e TNF-α, nonché una diminuzione delle concentrazioni di IL-2 nei tentativi di suicidio rispetto ai pazienti depressi non suicidari e ai controlli sani ( Janelidze et al., 2011 ). Lindqvist et al. (2009) hanno mostrato che l’IL-6 nel liquido cerebrospinale era significativamente più alta nei tentativi di suicidio rispetto ai soggetti sani di controllo.
I pazienti che hanno eseguito tentativi di suicidio violenti hanno mostrato il più alto livello di IL-6 ( Lindqvist et al., 2009 ). Mina et al. (2015) mostrano che l’IL-6 non solo risulta essere elevata nel liquido cerebrospinale dei tentatori di suicidio, anche i suoi livelli nel sangue periferico sono stati proposti come marker di suicidio biologico ( Miná et al., 2015 ). Il nostro studio attuale è in accordo con questi risultati precedenti.
Pertanto, il nostro studio mostra che i bambini con depressione e/o ansia hanno una disregolazione del sistema immunitario che non si risolve nonostante il trattamento con SSRI. Questa disregolazione è espressa in livelli crescenti di IL-6 e IL-1β dopo 6 mesi di trattamento ed è significativamente pronunciata nei bambini con tendenze suicide. Inoltre, i bambini ad alto rischio di suicidalità (quelli con suicidalità pretrattamento) che sviluppano suicidalità associata a SSRI hanno livelli di IL-6 più elevati dopo 6 mesi di trattamento rispetto a quelli che non sviluppano questo fenomeno.
Sembra che nei bambini inclini al suicidio associato al trattamento con SSRI, vi sia un’incapacità di SSRI di sopprimere l’aumento della sintesi di IL-6 e l’accumulo persistente di citochine può portare a SB. Gli elevati livelli di IL-6 espongono questi bambini a un rischio ancora maggiore di suicidalità.
4.1 . Limitazioni
Per una descrizione completa dei limiti del presente studio, condivisa dal nostro studio precedente, fare riferimento a Amitai et al. (2019). Una limitazione è la natura eterogenea del campione e la mancanza di un gruppo di controllo sano. Un’ulteriore limitazione nell’attuale studio è che non abbiamo avuto misure cliniche dopo 6 mesi di trattamento, ad eccezione della CGI-I. È possibile che i bambini con un processo infiammatorio più pronunciato dopo 6 mesi abbiano un profilo clinico diverso rispetto ai bambini con una risoluzione del processo infiammatorio.
Inoltre, viste le ben note fluttuazioni dei parametri immunologici nel tempo, sarebbe stato preferibile disporre di alcuni punti di misura in più. Al momento i dati attuali possono solo indicare un’associazione tra IL-6 e suicidalità al punto temporale di 6 mesi. Pertanto, l’implicazione clinica della misurazione del punto temporale di 6 mesi non è attualmente chiara. Ciò nonostante, questa osservazione supporta i nostri precedenti risultati riguardanti IL-6 come potenziale biomarcatore infiammatorio per SB associato a SSRI.
In particolare, quando si confrontano le variabili cliniche tra pazienti con o senza SB emergente da SSRI, il rapporto tra i sessi e i tassi di risposta differiscono notevolmente tra i gruppi, ma senza raggiungere la significatività statistica (vedi Tabella 1 ). Poiché il genere e la risposta al trattamento sono due fattori associati ai livelli di citochine pro-infiammatorie, è importante ripetere questa analisi in futuro in studi su larga scala per controllare tali possibili fattori di confondimento. Un’altra limitazione dello studio attuale (e anche del nostro precedente) è che abbiamo misurato solo tre citochine. Un approccio di analisi della rete di citochine può essere più completo delle analisi che si concentrano su uno o pochi marcatori, poiché ci sono spesso effetti sinergici e distinti, a seconda del tipo di rete immunobiologica attiva.
5. Conclusione
In questo studio, abbiamo valutato i profili delle citochine di bambini con disturbi dell’umore e d’ansia dopo 6 mesi di trattamento con SSRI. Abbiamo identificato un profilo biologico unico in soggetti con aumentato rischio di suicidio. Questo risultato è in accordo con il nostro precedente studio a breve termine (8 settimane) ( Amitai et al., 2019 ) e molti altri studi che hanno implicato IL-6 come potenziale biomarcatore con rilevanza clinica per la suicidalità. Il nostro studio sottolinea l’IL-6 circolatorio come un potenziale biomarcatore infiammatorio di importanza specifica nella fisiopatologia dell’SB associato a SSRI. Sono necessari ulteriori studi per far progredire la comprensione dei complessi processi immunobiologici alla base sia della risposta clinica agli SSRI che del rischio di suicidio associato agli SSRI.
Ruolo della fonte fondatrice
Nessuna.
Contributi
M Amitai ha progettato lo studio e scritto la prima bozza, Michal Taler ha gestito il lavoro di laboratorio, Maya Lebow ha gestito le ricerche e le analisi della letteratura, Reut Ben-Baruch ha aiutato a raccogliere i dati clinici, Alan Apter ha aiutato a reclutare i pazienti e a raccogliere i dati clinici , Abraham Weizman ha contribuito alla progettazione dello studio e ha curato la bozza finale, Silvana Fennig ha commentato la bozza finale, Alon Chen ha contribuito alla progettazione dello studio. Tutti gli autori hanno contribuito e hanno approvato il manoscritto finale.
Conflitto d’interesse
Nessuna.
Ringraziamenti
Ringraziamo la signorina Keverne, che ha assistito alla preparazione e alla correzione delle bozze del manoscritto.
Materiale supplementare
Scarica : Scarica documento Word (13KB)
Riferimenti
- American Psychiatric Association, 2013. Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition American Psychiatric Association, Arlington, VA (DSM-5).
- Amitai, M., 2019. Increased circulatory IL-6 during 8-week fluox- etine treatment is a risk factor for suicidal behaviors in youth [published online ahead of print, 2019 Dec 27]. Brain Behav. Im- mun. S0889-1591 (19), 31330–31333.
- Bai, S., Guo, W., Feng, Y., Deng, H., Li, G., Nie, H., Guo, G., Yu, H. Ma, Y., Wang, J., Chen, S., Jing, J., Yang, J., Tang, Y., Tang, Z., 2019. Efficacy and safety of anti-inflammatory agents for the treatment of major depressive disorder: a systematic review and meta-analysis of randomised controlled trials. J. Neurol. Neurosurg. Psychiatry 1–12.
- Bastos, C.R., Gazal, M., de, A., Quevedo, L., Costa, J.L., Wiener, C.D., Jansen, K., de Mola, C.L., Oses, J.P., Souza, L.D.M., Portela, L.V., Pinheiro, R.T., da Silva, R.A., Lara, D.R., Ghisleni, G., 2017. Polymorphism in CRHR1 gene af- fects the IL-1β levels in suicidal attempters. J. Psychiatr. Res. 86, 34–38.
- Black, C., Miller, B.J., 2015. Meta-analysis of cytokines and chemokines in suicidality: distinguishing suicidal versus non- suicidal patients. Biol. Psychiatry 78, 28–37.
- Blardi, P., De Lalla, A., Leo, A., Auteri, A., Iapichino, S., Di Muro, A., Dell’Erba, A., Castrogiovanni, P., 2002. Serotonin and fluoxetine levels in plasma and platelets after fluoxetine treat- ment in depressive patients. J. Clin. Psychopharmacol. 22, 131– 136.
- Coryell, W., Wilcox, H., Evans, S.J., Pandey, G.N., Jones- Brando, L., Dickerson, F., Yolken, R., 2018. Aggression, impul- sivity and inflammatory markers as risk factors for suicidal be- havior. J. Psychiatr. Res. 106, 38–42.
- Courtet, P., Giner, L., Seneque, M., Guillaume, S., Olie, E., Ducasse, D., 2016. Neuroinflammation in suicide: toward a comprehensive model. World J. Biol. Psychiatry 17, 564–586.
- Dantzer, R., O’Connor, J.C., Freund, G.G., Johnson, R.W., Kel- ley, K.W., 2008. From inflammation to sickness and depression: when the immune system subjugates the brain. Nat. Rev. Neu- rosci.
- Dowlati, Y., Herrmann, N., Swardfager, W., Liu, H., Sham, L., Reim, E.K., Lanctôt, K.L., 2010. A meta-analysis of cytokines in major depression. Biol. Psychiatry 67, 446–457.
- Ducasse, D., Olié, E., Guillaume, S., Artéro, S., Courtet, P., 2015. A meta-analysis of cytokines in suicidal behavior. Brain. Behav. Immun. 46, 203–211.
- Eller, T., Vasar, V., Shlik, J., Maron, E., 2008. Pro-inflammatory cy- tokines and treatment response to escitaloprsam in major de- pressive disorder. Prog. Neuro-Psychopharmacol. Biol. Psychia- try 32, 445–450.
- Erhardt, S., Lim, C.K., Linderholm, K.R., Janelidze, S., Lindqvist, D., Samuelsson, M., Lundberg, K., Posto- lache, T.T., Träskman-Bendz, L., Guillemin, G.J., Brundin, L., 2013. Connecting inflammation with glutamate agonism in suicidality. Neuropsychopharmacology 38, 743–752.
- Felger, J.C., Lotrich, F.E., 2013. Inflammatory cytokines in depres- sion: neurobiological mechanisms and therapeutic implications. Neuroscience 246, 199–229.
- Ganança, L., Oquendo, M.A., Tyrka, A.R., Cisneros-Trujillo, S., Mann, J.J., Sublette, M.E., 2016. The role of cytokines in pathophysiology of suicidal behavior. Psychoneuroendocrinology 63, 296–310.
- Guy, W., 1976. Clinical Global Improvement Scale. Assessment Man- ual of Psychopharmacology. National Institute of Mental Health, Rockville, MD.
- Haapakoski, R., Mathieu, J., Ebmeier, K.P., Alenius, H., Kivimäki, M., 2015. Cumulative meta-analysis of interleukins 6 and 1β, tumour necrosis factor α and C-reactive protein in patients with major depressive disorder. Brain. Behav. Immun. 49, 206–215.
- Hammad, T.A., Laughren, T., Racoosin, J., 2006. Suicidality in pe- diatric patients treated with antidepressant drugs. Arch. Gen. Psychiatry 63, 332–339.
- Hannestad, J., Dellagioia, N., Bloch, M., 2011. The effect of antide- pressant medication treatment on serum levels of inflammatory cytokines: a meta-analysis. Neuropsychopharmacology 36, 2452–2459.
- Hernández, M.E., Mendieta, D., Martínez-Fong, D., Loría, F., Moreno, J., Estrada, I., Bojalil, R., Pavón, L., 2008. Variations in circulating cytokine levels during 52 week course of treatment with SSRI for major depressive disorder. Eur. Neuropsychophar- macol. 18, 917–924.
- Hiles, S.A., Baker, A.L., De Malmanche, T., Attia, J., 2012. Interleukin-6, C-reactive protein and interleukin-10 after antidepressant treatment in people with depression: a meta-analysis. Psychol. Med. 42, 2015–2026.
- Isung, J., Aeinehband, S., Mobarrez, F., Nordström, P., Runeson, B., Asberg, M., Piehl, F., Jokinen, J., 2014. High interleukin-6 and impulsivity: determining the role of endophenotypes in ataced responses to shared inflammatory pathways. BMC Med. 10, 1–19.
- Miller, A.H., Maletic, V., Raison, C.L., 2009. Inflammation and its discontents: the role of cytokines in the pathophysiology of major depression. Biol. Psychiatry 65, 732–741.
- Mills, N.T., Scott, J.G., Wray, N.R., Cohen-Woods, S., Baune, B.T., 2013. Research Review: the role of cytokines in depression in adolescents: a systematic review. J. Child Psychol. Psychiatry 54, 816–835.
- Miná, V.A.L., Lacerda-Pinheiro, S.F., Maia, L.C., Pinheiro, R.F.F.,Meireles, C.B., de Souza, S.I.R., Reis, A.O.A., Bianco, B., Rolim, M.L.N., 2015. The influence of inflammatory cytokines in physiopathology of suicidal behavior. J. Affect. Disord. 172, 219–230.
- Mitchell, R.H.B., Goldstein, B.I., 2014. Inflammation in children and adolescents with neuropsychiatric disorders: a systematic review. J. Am. Acad. Child Adolesc. Psychiatry 53, 274–296.
- Pandey, G.N., 2015. Cytokines as suicide risk biomarkers. Biol. Psy- chiatry 78, 5–6.
- Pandey, G.N., Rizavi, H.S., Zhang, H., Bhaumik, R., Ren, X., 2018. Abnormal protein and mRNA expression of inflammatory cy- tokines in the prefrontal cortex of depressed individuals who died by suicide. J. Psychiatry Neurosci. 43, 376–385.
- Posner, K., Brown, G.K., Stanley, B., Brent, D.A., Yershova, K.V., Oquendo, M.A., Currier, G.W., Melvin, G.A., Greenhill, L., Shen, S., Mann, J.J., 2011. The Columbia-suicide severity rat- ing scale: initial validity and internal consistency findings from three multisite studies with adolescents and adults. Am. J. Psy- chiatry 168, 1266–1277.
- Janelidze, S., Mattei, D., Westrin,A˚., Träskman-Bendz, L.,Schmidt, F.M., Schröder, T., Kirkby, K.C., Sander, C., Suslow, T.,Brundin, L., 2011. Cytokine levels in the blood may distinguish suicide attempters from depressed patients. Brain. Behav. Im- mun. 25, 335–339.
- Keaton, S.A., Madaj, Z.B., Heilman, P., Smart, L.A., Grit, J., Gibbons, R., Postolache, T.T., Roaten, K., Achtyes, E.D., Brundin, L., 2019. An inflammatory profile linked to increased suicide risk. J. Affect. Disord. 247, 57–65.
- Kubera, M., Maes, M., Kenis, G., Kim, Y.K., Lason´, W., 2005. Effects of serotonin and serotonergic agonists and antagonists on the production of tumor necrosis factor α and interleukin-6. Psychi- atry Res. 134, 251–258.
- Lichtblau, N., Schmidt, F.M., Schumann, R., Kirkby, K.C., Him- merich, H., 2013. Cytokines as biomarkers in depressive dis- order: current standing and prospects. Int. Rev. Psychiatry 25, 592–603.
- Lindqvist, D., Janelidze, S., Hagell, P., Erhardt, S., Samuelsson, M., Minthon, L., Hansson, O., Björkqvist, M., Träskman-Bendz, L., Brundin, L., 2009. Interleukin-6 is elevated in the cerebrospinal fluid of suicide attempters and related to symptom severity. Biol. Psychiatry 66, 287–292.
- Maes, M., Berk, M., Goehler, L., Song, C., Anderson, G., Gałecki, P., Leonard, B., 2012. Depression and sickness behavior are Janus-Holdt, L.M., Teupser, D., Hegerl, U., Himmerich, H., 2016. Pro- and anti-inflammatory cytokines, but not CRP, are inversely cor- related with severity and symptoms of major depression. Psy- chiatry Res. 239, 85–91.
- Serafini, G., Pompili, M., Seretti, M.E., Stefani, H., Palermo, M., Coryell, W., Girardi, P., 2013. The role of inflammatory cy- tokines in suicidal behavior: a systematic review. Eur. Neuropsy- chopharmacol. 23, 1672–1686.
- Strawbridge, R., Arnone, D., Danese, A., Papadopoulos, A., Her- ane Vives, A., Cleare, A.J., 2015. Inflammation and clini- cal response to treatment in depression: a meta-analysis. Eur. Neuropsychopharmacol. 25, 1532–1543.
- Wang, L., Wang, R., Liu, L., Qiao, D., Baldwin, D.S., Hou, R., 2019. Effects of SSRIs on peripheral inflammatory markers in patients with major depressive disorder: a systematic review and meta- analysis. Brain. Behav. Immun. 79, 24–38.
- Wilkinson, P., Kelvin, R., Roberts, C., Dubicka, B., Goodyer, I., 2011. Clinical and psychosocial predictors of suicide attempts and nonsuicidal self-injury in the Adolescent Depression Antide- pressants and Psychotherapy Trial (ADAPT). Am. J. Psychiatry 168, 495–501.